Dopo quasi tre anni di gestazione, tra studi sulla valutazione d’impatto e consultazioni con gli esperti del settore, la Commissione europea ha presentato il 14 luglio scorso una proposta di Regolamento europeo sui “parametri di qualità e sicurezza per le sostanze di origine umana destinate all’applicazione sugli esseri umani”. L’acronimo adottato per descrivere questa categoria è quello di Soho, Substances of Human Origin, in cui si intendono incluse tutte le sostanze di origine umana, a eccezione degli organi solidi.
Si tratta di un aggiornamento della normativa in materia di sangue, tessuti e cellule adottata circa vent’anni fa (direttiva sul sangue 2002/98/Ce e direttiva sui tessuti e sulle cellule 2004/23/Ce), oggi in parte obsoleta e in parte applicata in maniera incoerente nei diversi Stati membri, ragion per cui si è scelto lo strumento del Regolamento, direttamente applicabile nella legislazione nazionale, a sostituire delle direttive che richiedono invece una trasposizione attraverso norme locali.
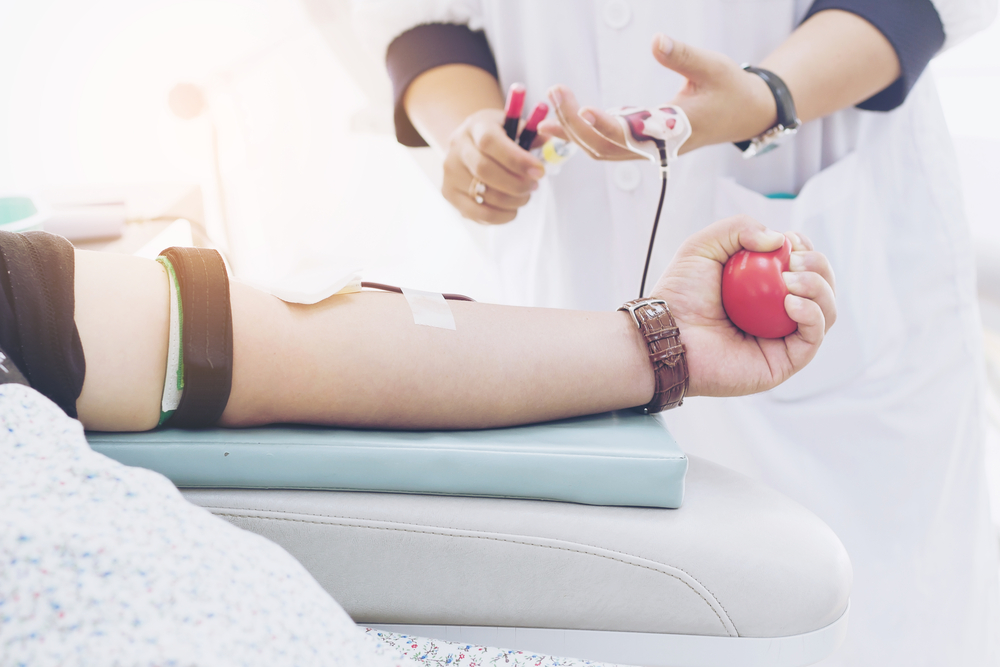
I trattamenti basati sulle sostanze di origine umana hanno un valore inestimabile, permettendo ogni anno di salvare la vita di milioni di persone attraverso trasfusioni di sangue nel quadro di interventi chirurgici o della gestione dei traumi, trapianti di cellule staminali per curare tumori del sangue e trapianti di pelle a seguito di ustioni e altre lesioni, fino alla procreazione medicalmente assistita. E la lista non è esaustiva.
Le implicazioni di questa normativa sono significative per molti aspetti. Essa stabilisce requisiti di qualità e sicurezza per tutte le attività, dalla donazione di sangue e plasma all’applicazione sugli esseri umani – quindi di fatto determinando una maggiore protezione dei riceventi di terapie Soho, come pure dei donatori di Soho e della progenie nata da procreazione medicalmente assistita – salvo qualora le donazioni siano utilizzate per la fabbricazione di medicinali o dispositivi medici, nel qual caso la normativa si applica unicamente alla donazione, alla raccolta e al controllo.
Una materia da sempre complessa e sensibile, che vede diversi stakeholder schierati su posizioni talvolta antitetiche. Che si tratti di organizzazioni non-profit responsabili per la raccolta di sangue e plasma o di frazionamento del plasma a uso terapeutico, oppure di produttori di farmaci plasma-derivati, le legittime prospettive ed esigenze di ognuno possono rivelarsi difficilmente conciliabili.
Un aspetto dibattuto da decenni riguarda la donazione volontaria e non remunerata del plasma usato per frazionamento e, dunque, per la preparazione di farmaci salva-vita. Sebbene tale principio sia esplicitamente previsto a livello nazionale e internazionale (per esempio nelle raccomandazioni del Consiglio d’Europa), alcuni Paesi europei e segnatamente l’Austria, la Germania, la Repubblica Ceca e l’Ungheria permettono la raccolta di plasma da parte di aziende private con un compenso ai donatori, arrivando a raccogliere addirittura il 44% del totale di plasma frazionato in tutta l’Unione europea.
Considerato che l’Europa dipende dall’importazione di plasma dagli Stati Uniti per circa il 40% del suo fabbisogno annuale, appare chiaro come l’obiettivo strategico di autosufficienza promosso dall’Ue possa risultare in contraddizione con i limiti imposti al settore privato. Una pragmatica apertura alla collaborazione tra il settore privato e quello pubblico rispetto alla donazione di plasma sarebbe probabilmente una soluzione utile a tale scopo, nel rispetto della protezione dei donatori da rischi di sfruttamento oltre che per la propria salute.
In effetti, la proposta della Commissione riconosce ai donatori di plasma via plasmaferesi la possibilità di ricevere un compenso in ragione del tempo dedicato e le spese incorse, sulla base di procedure da definire da parte degli Stati membri.
La decisione di differenziare il plasma per la produzione di medicinali rispetto al sangue e gli altri componenti usati per trasfusioni è stato apprezzato dall’industria e potrebbe preludere a ulteriori politiche che mirano a raggiungere una maggiore autosufficienza.
Alcune novità della proposta riguardano l’utilizzo delle competenze degli organismi tecnici esistenti in Europa, in particolare del Centro europeo per la prevenzione e il controllo delle malattie (Ecdc) e della Direzione europea della qualità dei medicinali e cura della salute del Consiglio d’Europa, per mantenere aggiornati gli orientamenti tecnici; la registrazione di tutti gli enti che svolgono attività che incidono sulla sicurezza e sulla qualità delle Soho e l’istituzione di un comitato di coordinamento europeo.
I prossimi passi dell’iter legislativo prevedono che la proposta della Commissione venga trasmessa ed esaminata dal Parlamento Ue e dal consiglio dell’Unione europea, fino all’approvazione di un testo definitivo nel corso del prossimo anno. Un dibattito che si preannuncia effervescente in cui non mancheranno le prospettive offerte dalle diverse parti interessate.